-
受付時間
精神科外来
初診受付時間:(予約制)
再診受付時間:8時30分~16時30分(予約制)
児童思春期外来
初診受付時間:(予約制)
再診受付時間:8時45分~17時00分(予約制) -
面会時間
9時00分〜17時30分
入院されている病棟により多少違いますので、事前に病棟にご確認ください。
また、病状により面会を制限させていただく場合があります。 -
休診日
土曜日、日曜日、祝祭日、12月29日~1月3日
ただし、急患の場合はこの限りではありません。
072-847-3261(代表)までお電話ください。

診断・治療創生部門
T1-2 認知症ユニット



-
受付時間
精神科外来
初診受付時間:(予約制)
再診受付時間:8時30分~16時30分(予約制)
児童思春期外来
初診受付時間:(予約制)
再診受付時間:8時45分~17時00分(予約制) -
面会時間
9時00分〜17時30分
入院されている病棟により多少違いますので、事前に病棟にご確認ください。
また、病状により面会を制限させていただく場合があります。 -
休診日
土曜日、日曜日、祝祭日、12月29日~1月3日
ただし、急患の場合はこの限りではありません。
072-847-3261(代表)までお電話ください。
T1-2 認知症ユニット
T1-2 Dementia Research Unit
スタッフ
- ユニットリーダー 武田 朱公
(大阪大学大学院医学系研究科 臨床遺伝子治療学寄附講座兼任)
(大阪大学医学部附属病院 老年・高血圧内科兼任) - (takeda"at"cgt.med.osaka-u.ac.jp) ⇒"at"を@に変換してください
- 特別研究員 大山 茜
- 特別研究員 中嶋 恒男(米国ハーバード大学留学中)
- 特別研究員 伊藤 祐規(大阪大学大学院医学系研究科 臨床遺伝子治療学兼任)
- 特別研究員 池側 佑哉(住友病院 初期研修医)
- 特別研究員 勝久 美月
- 特別研究員 手代木 紳
- 特別研究員 山本 翔
- 特別研究員 大河原 桃子
- 特別研究員 前泉 優月
研究課題
早期の認知症を正確に診断するための次世代型病態評価システムの開発
研究内容
研究の背景と当ユニットが目指すもの
T1-2認知症ユニットの研究目標は、認知症を早期の段階で正確に診断するための次世代型病態評価システムを構築し、それを実地臨床で活用する実践的トランスレーショナル・リサーチを推進することです。
認知症の根本的な治療法は未だ確立されていませんが、軽度認知障害(Mild cognitive impairment)など早期の段階で診断して適切な介入を行えば、その後の発症予防や認知機能の維持が可能であることが多くの研究で示されています。しかしながら現状、認知症の早期診断に有効な方法は確立されていません。認知機能障害がある程度進行するまでは本人も家族も症状に気付かないことが多く、医療機関を受診するまでに時間がかかるのが一般的です。受診後も、問診・認知機能テストや脳画像評価など負担のかかる検査を必要とするため、最終的に診断が下されて治療方針が決定するまでには更に時間を要します。アルツハイマー型をはじめとする多くの認知症は進行性疾患であるため、この間にも病態は悪化していきます。この「認知症の最初の発見から正確な診断に至るまでの時間」を短縮するための次世代型病態評価システムを構築することが、当研究ユニットの目標です。
この目標を、認知症デジタルバイオマーカー(Digital biomarker)と生体液バイオマーカー(Biofluid biomarker)の有機的な統合によって達成したいと考えています。またその有用性を、質の高い臨床研究によって実証することを目指します。また、Digital biomarkerとBiofluid biomarkerから得られる情報をもとに患者病態の個別性を捉えることで、介入方法をパーソナライズし、認知症予防効果を個人レベルで最大化するためのシステムの構築を目指します。このために、AIロボットを利用した認知症Digital therapeuticsの開発を行います。
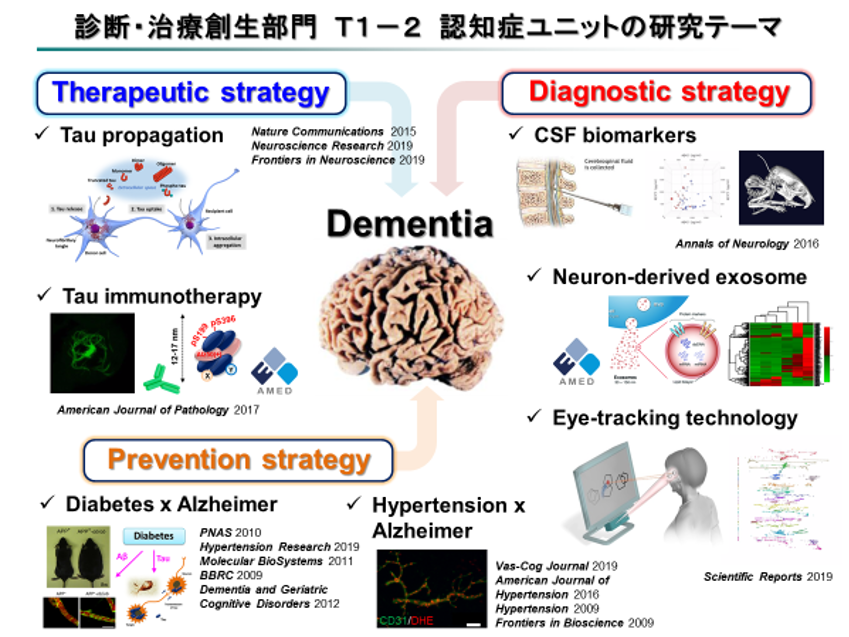
*本研究ユニットでは主に認知症の診断に関わるバイオマーカー開発に取り組みます(上図“Diagnostic strategy”)。
認知症デジタルバイオマーカーの開発
認知症の新しいデジタルバイオマーカーとして、アイトラッキングによる視線データ解析を活用した診断システムの開発を進めています(JVCケンウッド社の視線検出装置Gazefinderを利用)。ユニットリーダーらはこれまでに、わずか3分弱の映像を眺める視線の動きを解析することで、被検者の認知機能スコアを客観的かつ定量的に評価するシステムを開発してきました(Oyama, Takeda et al. Scientific Reports 2019)。今後このシステムの改良を進め、認知症の鑑別診断や認知機能予後の予測を可能にするアルゴリズムの開発を行います。AI解析によって複雑な視線情報の中から認知症の病態を反映する特徴を抽出することで、簡便でありながらも従来法を上回る精度を達成する新しい評価尺度の確立を目指しています。
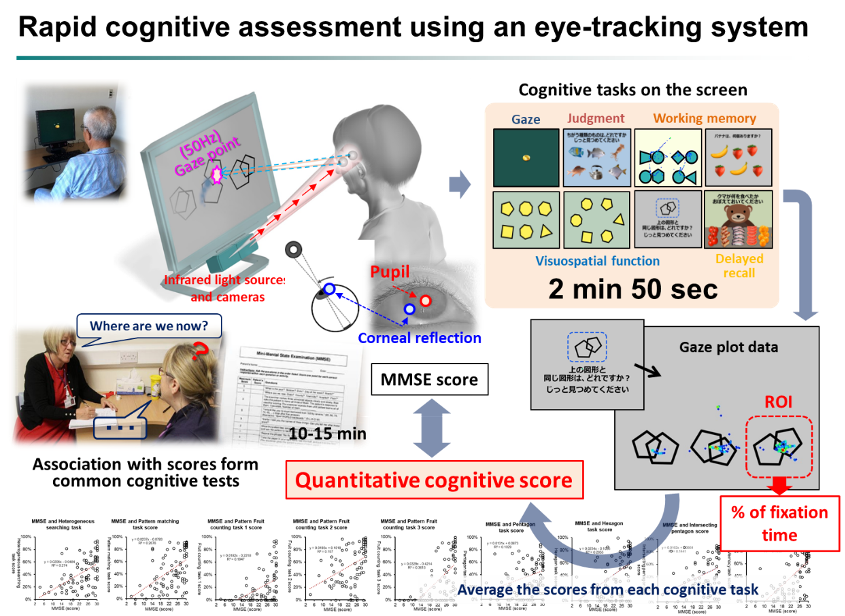
*アイトラッキング式認知機能評価法による認知症デジタルバイオマーカーの開発
認知症生体液バイオマーカーの開発
現在、アルツハイマー型認知症の生体液バイオマーカー(Biofluid biomarker)として脳脊髄液中のリン酸化タウやAβ42の測定が有用であることが知られており、最近では末梢血中での前記マーカーも同様の診断的価値を有することが明らかになっています。これら神経病理に関連したバイオマーカーは診断的有用性が高い一方で、患者の予後予測や治療効果のモニターなどには十分でないことが課題となっています。実際の認知症患者の病態は個人差が多くかつ複雑であるため、個々の症例に対して正確な病態把握と適切な治療方針の決定を行うためには、既存のバイオマーカーだけでは不十分です。そこで、認知症の病態をより多角的に評価するための新しい生体液バイオマーカーの開発とその有用性の実証が必要です。
生体液バイオマーカーの開発とその臨床的有用性の検証は、大阪大学大学院医学系研究科老年・総合内科および臨床遺伝子治療学(ユニットリーダー兼任)との共同研究として進めます。高品質の認知症バイオバンクの検体を利用し、新しいバイオマーカーの特性を詳細な臨床情報と照合することで明らかにし、その臨床的有用性を正確に見極めます。また、こころの科学リサーチセンターの他の研究ユニットとも有機的に連携し、新しい認知症バイオマーカーの開発を進めて行く予定です。基礎研究で生まれた新しいシーズが認知症の実地臨床で最大限に生きる形を見定めることも、本ユニットの重要な役割と考えています。
主な業績
-
【和文総説】
- 1.武田 朱公「最新技術を用いた認知症の早期スクリーニング ~5G時代の認知症医療を支えるプラットフォーム~」 医学と医療の最前線 『日本内科学会雑誌』110巻 3号 p636-642 (2021年3月10日発行)
- 2.武田 朱公「タウ伝播を標的とした治療法開発」 特集 神経変性疾患の治療開発の現状 -新たな戦略構築の基盤を目指して 『医学のあゆみ』Vol.273 No.1 p23-27(医歯薬出版株式会社 2020年4月4日発行)
- 3.武田 朱公「デジタルバイオマーカーによる認知症検査法の開発」『Neurologica』 2023 No.1、特集、pp06-09 (2023年2月28日 発行)
- 4.武田 朱公 基礎講座 エイジング・サイエンスと脳⑮「加齢脳のバイオマーカー」『老年精神医学雑誌』 Vol.33 No.12(通巻434号)、pp1323-30 (2022年12月20日 発行
- 5.武田 朱公 A SPECIAL EDITION 老化はなぜ進むのか? 「フレイル・認知症と脳の老化」『BIO Clinica』 Vol.37 No.14(通巻501号)、pp22-26 (2022年12月31日 発行)
-
【英文原著・総説】
1. Shuko Takeda, Hiromi Rakugi, and Ryuichi Morishita. Roles of vascular risk factors in the pathogenesis of dementia. Hypertension Research 43, p162–167 2020 - 2. Akane Oyama, Shuko Takeda (Corresponding author), Yuki Ito, Tsuneo Nakajima, Yoichi Takami, Yasushi Takeya, Koichi Yamamoto, Ken Sugimoto, Hideo Shimizu, Munehisa Shimamura, Taiichi Katayama, Hiromi Rakugi & Ryuichi Morishita. Novel Method for Rapid Assessment of Cognitive Impairment Using High-Performance Eye-Tracking Technology. Scientific Reports 9:12932 2019
- 3. Shuko Takeda. Tau Propagation as a Diagnostic and Therapeutic Target for Dementia: Potentials and Unanswered Questions. Frontiers in Neuroscience 13 Dec. 2019
- 4. Shuko Takeda. New insights into the role of lifestyle-related diseases on vascular dementia and Alzheimer's disease. Vas-Cog Journal, No.5, April 01. pp12-19. (ISSN: 24239372) 2019
- 5. Shuko Takeda. Progression of Alzheimer's disease, tau propagation, and its modifiable risk factors. Neuroscience Research Apr;141:36-42 2019
- 6. Chloe K. Nobuhara, Sarah L. DeVos, Caitlin Commins, Susanne Wegmann, Benjamin D. Moore, Allyson D. Roe, Isabel Costantino, Matthew P. Frosch, Rose Pitstick, George A. Carlson, Christoph Hock, Roger M. Nitsch, Fabio Montrasio, Jan Grimm, Anne E. Cheung, Anthone W. Dunah, Marion Wittmann, Thierry Bussiere, Paul H. Weinreb, Bradley T. Hyman, and Shuko Takeda (Last author). Tau antibody-targeting pathological species blocks neuronal uptake and inter-neuron propagation of tau in vitro. American journal of Pathology Jun;187(6):1399-1412. 2017
- 7. Shuko Takeda (Corresponding author), Caitlin Commins, Sarah L. DeVos, Chloe K. Nobuhara, Susanne Wegmann, Allyson D. Roe, Isabel Costantino, Zhanyun Fan, Samantha B. Nicholls, Alexis E. Sherman, Ana T. Trisini Lipsanopoulos, Clemens R. Scherzer, George A. Carlson, Rose Pitstick, Elaine R. Peskind, Murray A. Raskind, Ge Li, Thomas J. Montine, Matthew P. Frosch, MD, and Bradley T. Hyman. Seed-competent HMW tau species accumulates in the cerebrospinal fluid of Alzheimer’s disease mouse model and human patients. Annals of Neurology Sep;80(3):355-67, 2016
- 8. Shuko Takeda, Susanne Wegmann, Hansang Cho, Sarah L. DeVos, Caitlin Commins, Allyson D. Roe, Samantha B. Nicholls, George A. Carlson, Rose Pitstick, Chloe K. Nobuhara, Isabel Costantino, Matthew P. Frosch, Daniel J. Müller, Daniel Irimia, and Bradley T. Hyman. Neuronal uptake and propagation of a rare phosphorylated high-molecular-weight tau species derived from tau-transgenic mouse and human Alzheimer’s disease brain. Nature Communications, 6:8490, 2015
- 9. Wegmann S, Maury EA, Kirk MJ, Saqran L, Roe A, DeVos SL, Nicholls S, Fan Z, Takeda S, Cagsal-Getkin O, William CM, Spires-Jones TL, Pitstick R, Carlson GA, Pooler AM, Hyman BT. Removing endogenous tau does not prevent tau propagation yet reduces its neurotoxicity. EMBO J. 2015 Dec 14;34(24):3028-41.
- 10. Shuko Takeda, Naoyuki Sato and Ryuichi Morishita. Systemic inflammation, blood-brain barrier vulnerability and cognitive / non-cognitive symptoms in Alzheimer disease: Relevance to pathogenesis and therapy. Front. Aging Neurosci. 2014 doi: 10.3389/fnagi.2014.00171
- 11. Shuko Takeda, Naoyuki Sato, Kozue Uchio-Yamada, Kyoko Sawada, Takanori Kunieda, Daisuke Takeuchi, Hitomi Kurinami, Mitsuru Shinohara, Hiromi Rakugi, and Ryuichi Morishita. Diabetes accelerated memory dysfunction via cerebrovascular inflammation and Aβ deposition in an Alzheimer mouse model with diabetes. Proc Natl Acad Sci U S A, 107(15), pp7036-7041, 2010. PMCID:PMC2872449
- 12. Shuko Takeda, Tadafumi Hashimoto, Allyson D. Roe, Yukiko Hori, Tara L. Spires-Jones, and Bradley T. Hyman. Brain Interstitial Oligomeric Amyloid β Increases with Age and Is Resistant to Clearance from Brain in a Mouse Model of Alzheimer’s Disease. FASEB J, 27(8), pp3239-48, 2013
- 13. Shuko Takeda, Naoyuki Sato, Daisuke Takeuchi, Hitomi Kurinami, Mitsuru Shinohara, Kazue Niisato, Masanobu Kano, Toshio Ogihara, Hiromi Rakugi, and Ryuichi Morishita. Angiotensin Receptor Blocker Prevented β-Amyloid-Induced Cognitive Impairment Associated with Recovery of Neurovascular Coupling. Hypertension, 54(6), pp1345-1352, 2009
- 14. Shuko Takeda, Naoyuki Sato, Kazuko Ikimura; Hirohito Nishino; Hiromi Rakugi, and Ryuichi Morishita. Increased Blood-Brain Barrier Vulnerability to Systemic Inflammation in Alzheimer Disease Mouse Model. Neurobiology of Aging, 34(8), pp2064-70, 2013
- 15. Shuko Takeda, Naoyuki Sato, Kozue Uchio-Yamada, Hisahiro Yu, Atsushi Moriguchi, Hiromi Rakugi and Ryuichi Morishita. Oral Glucose Loading Modulates Plasma β-Amyloid Level in Alzheimer's Disease Patients: Potential Diagnostic Method for Alzheimer's Disease. Dement Geriatr Cogn Disord, 9;34(1), pp25-30, 2012
- 16. Shuko Takeda, Naoyuki Sato, Kazuko Ikimura, Hirohito Nishino, Hiromi Rakugi and Ryuichi Morishita. Novel microdialysis method to assess neuropeptides and large molecules in free-moving mouse. Neuroscience, 186, pp110-119, 2011
- 17. Shuko Takeda, Naoyuki Sato, Kozue Uchio-Yamada, Kyoko Sawada, Takanori Kunieda, Daisuke Takeuchi, Hitomi Kurinami, Mitsuru Shinohara, Hiromi Rakugi, and Ryuichi Morishita. Elevation of Plasma β-amyloid Level by Glucose Loading in Alzheimer Mouse Models. Biochemical and Biophysical Research Communications, 385, pp193-197, 2009
- トップ
- こころの科学リサーチセンター
- お知らせ
- T1-2 認知症ユニット
サイトマップ






